肿瘤难治,怎么办?
众所周知,肿瘤越来越成为人类健康的重大威胁。肿瘤细胞作为变异的自身细胞较难被机体清除外,多年的研究开发出来一些针对特定肿瘤的治疗方式还不能通用于其他类型的肿瘤,这就造成了许多治疗手段的治疗局限性,那么,有不有那么一种治疗手段,也许,能够对所有的肿瘤都有效呢?
或许真的有。
在《Journal of Biological Chemistry》(JBC)上刊登的一篇论文就提出了一个新的肿瘤治疗思路,截断肿瘤细胞的能量来源,来个釜底抽薪,饿死它们!
或许你会嗤之以鼻,饿死它们,正常细胞不也活不了了。这种方式不就和普通的放疗化疗一样,没有较好选择性,只知道不分青红皂白的杀伤所有细胞吗?治疗效果能好到哪儿去?
别慌,听我慢慢道来。
怎么饿死它们?
我们知道,正常的人体细胞的能量供应极大的依赖于三羧酸循环(TCA),而三羧酸循环需要循环的中间产物保持一定的浓度才能正常进行,否则,这个过程就会受到严重影响,进而影响到细胞获取能量与产生足够的代谢需要的各种小分子前体。
了解到这一点,我们就会明白一些快速生长的细胞,比如肿瘤细胞,因为相对而言极为缺少这些中间产物,三羧酸循环显然不能为它们提供足够的能量来源。怎么办呢?狡猾的肿瘤进化(发展)出一种新的能量利用途径——谷氨酰胺降解,这个线性变化版本的TCA通过直接利用谷氨酰胺分解来产生大量能量与代谢需要的小分子前体从而满足肿瘤细胞快速生长的需要。
好像可以欢饮鼓舞了,哈,阻断了这个途径,肿瘤你还不得像无根之木一样啊。应该是这样,而且,如果我们能从源头上阻断这个途径——阻止肿瘤细胞摄取谷氨酰胺,是不是应该是最好的治疗手段呢?
从这个思路出发,JBC上的这篇论文就设计了他们的实验。肿瘤摄取谷氨酰胺需要的是相应的管氨酰胺转运体,而现在鉴别出来的这些转运体包括SNAT1,SNAT2,SNAT4,LAT1,ASCT2等,一般认为ASCT2和LAT1是对肿瘤细胞来说最重要的。因此,这个研究也主要针对阻断这两种转运体来设计。
接触肿瘤学较多的科学家可能会替论文的研究者担忧了,这两种转运体在肿瘤细胞中的高表达已经被证实超过10年了,前人已经做了不少研究,认为ASCT2对于谷氨酰胺的净摄取更为重要,因此阻断它十分必要,但是现存的它的阻断剂,benzylserine和γ-谷氨酰-对硝基苯胺盐酸盐的特异性以及效果都不好,根本不可能起到治疗作用。
怎么办呢?研究人员Angelika Bröer等采用RNAi技术来沉默ASCT2的表达,却发现它也只能使谷氨酰胺的摄取减少50%,随后,他们又用CRISPR/Cas-9技术来制作ASCT2 (-/-)系肿瘤细胞,发现也只能能使谷氨酰胺的摄取减少60%。
为什么效果不好呢?研究者观察到,在这种缺少ASCT2的细胞中,他们SNAT1的运输活性、蛋白水平等都是提升的。同时,这种细胞系摄取谷氨酰胺的水平虽然下降了,但是细胞生长活性以及谷氨酰胺的净摄取实际上相对母系细胞是大致相同的。另外,[13C5]谷氨酰胺代谢标记实验也证明,在母系以及ASCT2 (-/-)系细胞中,放射性的谷氨酰胺降解产物大量存在。
这些实验结果都提示,ASCT2对谷氨酰胺的净摄取作用不大,抑制了ASCT2的活性,SNAT1的活性会后继升高,一定程度的补偿它的作用。另外,SNAT1在谷氨酰胺的净摄取中具有重要意义。
还有其他转运体参与吗?有的,ASCT2的表达降低能够使 tRNA卸载反应增多,这个反应又能使SNAT2表达增加,从而弥补ASCT2的作用。而且,在上述的ASCT2 (-/-)中,单独沉默SNAT1对肿瘤细胞生长活性影响不大。(图1)显示可能SNAT2有补偿作用。
因此,研究者又在这种细胞中沉默GCN2的表达(降低上述的tRNA卸载反应从而降低SNAT2的水平),果然,肿瘤细胞的生长活性从K=0.035降至0.0018。这个结果已经足够令人惊喜,还有没有更方便的手段呢?
研究者考虑到SNAT1的重大作用,遂将SNAT1和SNAT2分别沉默(前者采用RNAi,后者采用抑制剂MeAIB),发现竟然能将母系肿瘤细胞的活性从K=0.05剧降至0.003。(图1)
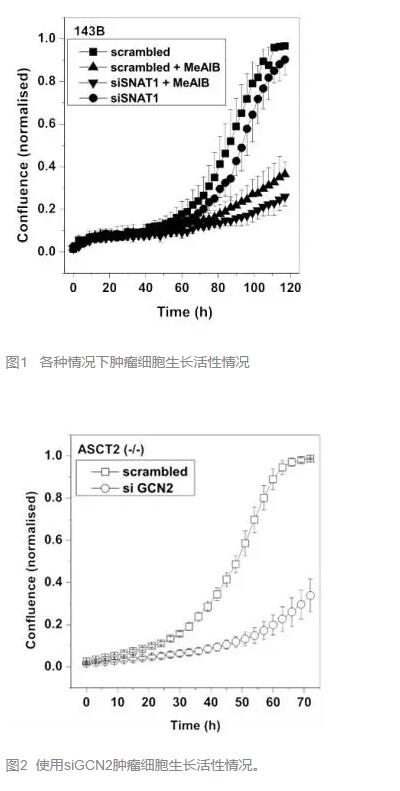
喜大普奔?
论文的结果显示,他们的研究证实了这三种转运体在肿瘤生长中的重要作用,如果采用恰当的手段阻断这些转运体,将可以极有效的抑制肿瘤生长,从而达到治疗作用。
当然,前景是美妙的,道路是曲折的。这个研究也并不意味着我们就可以直接采用这种方式完全控制肿瘤。首先,此研究只选取了两种肿瘤细胞,宫颈癌HeLa细胞和骨肉瘤143B细胞,其他肿瘤细胞哪些转运体更重要我们还不能贸然下结论。其次,细胞实验的结果还需要进一步的动物实验和临床试验来验证。
但是,这项研究终归为我们对抗肿瘤提供了一项新的可行性思路,有望在将来开发出更安全、应用范围更广泛、效果更优异的肿瘤治疗手段,帮助人类有效的对抗这个不久之前谈之色变的恶性杀手。
(本文为“医学界肿瘤频道”原创文章,转载需授权并注明作者和来源。)
参考文献:
Bröer A, Rahimi F, Bröer S. Deletion of amino acid transporter ASCT2 (SLC1A5) reveals an essential role for transporters SNAT1 (SLC38A1) and SNAT2 (SLC38A2) to sustain glutaminolysis in cancer cells. JBC Papers in Press. Published on April 26, 2016 as Manuscript M115.700534.





